Curare con le particelle
Verso terapie più efficaci e personalizzate
di Simona Giordanengo

Il ciclotrone SPES, un acceleratore circolare di protoni, operativo presso i Laboratori Nazionali di Legnaro dell'INFN per esperimenti di fisica nucleare e per la produzione di radiofarmaci.
Iniziata alla fine del XIX secolo, con la scoperta dei raggi X da parte di Wilhelm C. Röntgen e della radioattività da parte di Henri Becquerel e dei coniugi Pierre e Marie Curie, la fisica applicata alla medicina ha dotato il medico di strumenti per riconoscere i tumori e per trattarli senza dover ricorrere necessariamente alla chirurgia.
Fasci di raggi X e particelle (elettroni, protoni, neutroni e ioni), prodotti da sofisticati acceleratori, sono in grado di penetrare in profondità nella materia innescando il processo fisico di ionizzazione lungo il percorso. Nel caso dei tessuti biologici questo processo può provocare vari tipi di danno che, se sfruttati opportunamente, possono portare alla guarigione da un tumore.
Biologi, fisici e medici, in sinergia, utilizzano le loro specifiche competenze per studiare gli effetti biologici delle differenti radiazioni e sviluppare tecnologie innovative di irraggiamento. Lo scopo di ogni radioterapia è depositare nei differenti tessuti una quantità di energia (detta "dose") capace di provocare un danno biologico tale da inibire la crescita del tumore con effetti collaterali minimi e, se possibile, a basso costo.
I contributi della fisica alla radioterapia sono molteplici e interdisciplinari. Partendo dallo studio delle radiazioni e della loro interazione con la materia e sfruttando gli sviluppi degli esperimenti di fisica nucleare, si progettano acceleratori medicali e rivelatori di particelle di crescente complessità, rendendo via via più precise ed efficaci sia le terapie che raggiungono i tumori dall’esterno, sia le terapie che utilizzano radiazioni prodotte direttamente nel tumore tramite farmaci radioattivi (vd. approfondimento).
Gli acceleratori lineari sono diffusi in clinica per produrre fasci di raggi X e di elettroni. I ciclotroni, con diametro di circa 5 metri, si usano per fasci di protoni (vd. Asimmetrie n. 6) e i sincrotroni con diametro di oltre 20 metri sono necessari per produrre principalmente fasci terapeutici di ioni carbonio. La svolta per la diffusione dei trattamenti con ioni è attesa dallo sviluppo di innovativi magneti superconduttori che affrontano la sfida di realizzare acceleratori più compatti e meno costosi di quelli esistenti.
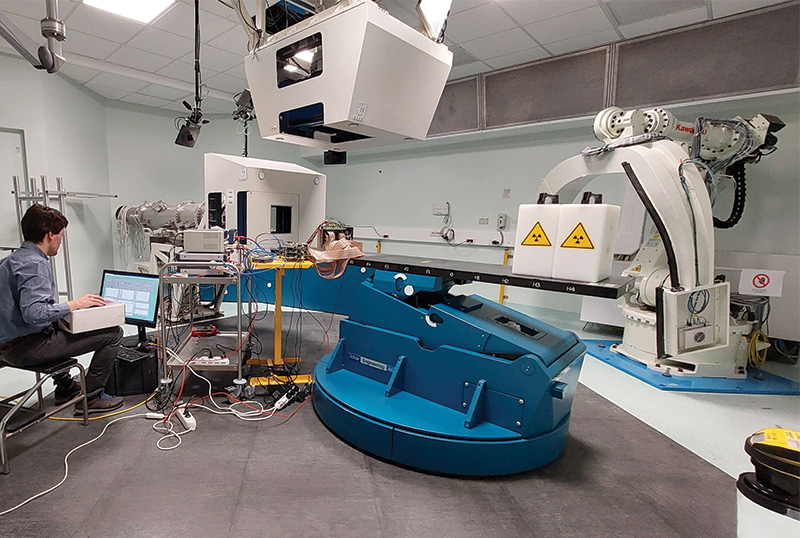
La sala di trattamento del CNAO durante un’attività di ricerca. Sul lettino al posto del paziente è presente un rivelatore in corso di sviluppo e in fase di test con i fasci usati per la terapia. Il fascio può raggiungere il paziente o il rivelatore sia dall’alto che da sinistra. Dentro le due strutture bianche in alto e a sinistra, sono presenti rivelatori monitor di fascio che controllano il campo di radiazione e guidano i trattamenti.
Tecnologie di frontiera per rivelatori di radiazione sono utilizzate per garantire l’efficacia del trattamento e la sicurezza del paziente. Rivestono particolare importanza i sistemi di dosimetria utilizzati per verificare la dose in opportuni fantocci prima degli irraggiamenti del paziente e i monitor di fascio (vd. fig. b) che guidano e controllano il campo di radiazione durante i trattamenti. Inoltre, differenti tipologie di rivelatori posizionati attorno al paziente permettono di misurare la radiazione generata dall’interazione del fascio con i tessuti del paziente.
Per studiare l’efficacia delle radiazioni a livello cellulare e sub-cellulare è necessario misurare la dose in volumi micro e nanometrici tramite micro- e nano-dosimetri, strumenti essenziali per comprendere i meccanismi di interazione delle diverse radiazioni che inducono effetti biologici letali sulle cellule o, viceversa, che favoriscono il recupero di quelle sane. In forte sinergia con i radiobiologi si cerca di capire e descrivere, con modelli matematici, la relazione tra la sopravvivenza di specifiche linee cellulari e parametri come il tipo di radiazione, la quantità, il rateo e il frazionamento della dose somministrata.
Tutti gli sviluppi qui elencati utilizzano simulazioni di processi fisici e radiobiologici, e metodi di analisi dei dati, e richiedono, oltre alla fisica, competenze di elettronica, computing, fisica dei materiali e radiobiologia.
I ricercatori italiani hanno avuto un importante ruolo nel dimostrare l’impatto positivo e la fattibilità della terapia con protoni e ioni, mettendo a disposizione l’acceleratore dei Laboratori Nazionali del Sud di Catania per i pionieristici trattamenti di tumori oculari. Molto dobbiamo alla lungimiranza del fisico italiano Ugo Amaldi, che portò l’Italia nel 2011 a essere la seconda nazione europea ad avere un Centro Nazionale di Adroterapia Oncologica (CNAO) capace di trattare i pazienti sia con protoni sia con ioni carbonio. Oggi ne esistono sei in tutto il mondo.
Tra le principali sfide della terapia con protoni e ioni vi è quella di migliorare la precisione con cui è rilasciata la dose nel paziente, tenendo anche conto del movimento respiratorio durante il trattamento. Medici e fisici, per pianificare un trattamento, usano l’immagine statica della TAC, che però non può tenere conto dei cambiamenti anatomici che possono esserci, anche in breve tempo, nel tumore e negli organi a rischio circostanti. Per questa ragione, per trattare particolari organi come polmoni, fegato, pancreas e, in generale, i tumori nell’addome, occorrono strumenti innovativi per misurare il movimento dei tessuti interni, con l’obiettivo di adattare la terapia agli spostamenti osservati. La velocità e la precisione dei complessi sistemi di calcolo per la ricostruzione delle immagini e per la pianificazione della dose diventano essenziali e l’intelligenza artificiale gioca qui un ruolo decisivo.
L’utilizzo della risonanza magnetica durante un trattamento con raggi X è un altro importante traguardo della fisica che permette di controllare, appena prima e durante il trattamento, le dimensioni e la posizione dei tessuti interessati.
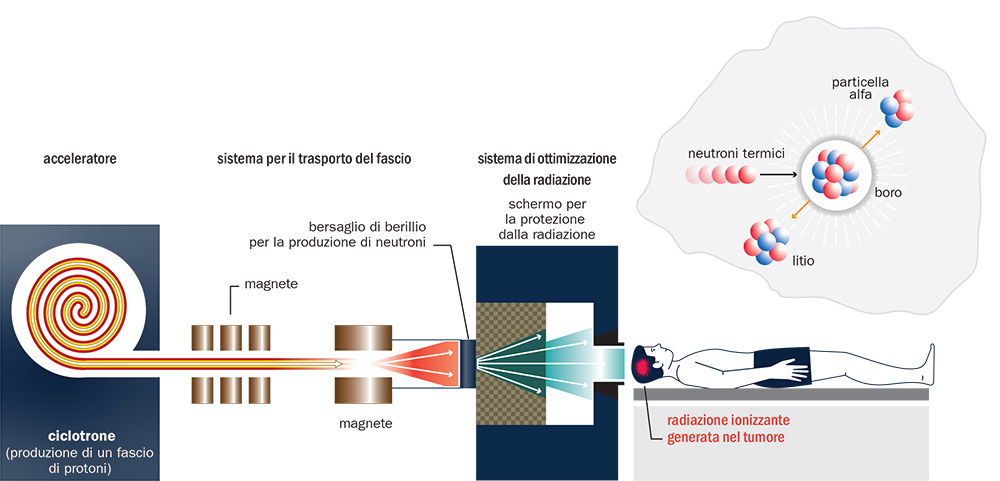
Componenti di un sistema per l’implementazione clinica della boron neutron capture therapy (BNCT). Il ciclotrone accelera protoni che, attraverso una linea di estrazione, incidono su un bersaglio di berillio da cui si producono i neutroni ad alta energia. Prima di raggiungere il paziente l’energia dei neutroni si riduce e, attraverso un moderatore e un collimatore in uscita, il campo di radiazione viene adattato alla dimensione della zona da irraggiare. In alto a destra è presente lo schema del decadimento del nucleo di boro in un nucleo di litio e un nucleo di elio dopo aver interagito con un neutrone.
Unire la terapia con la diagnostica è anche la chiave della promettente terapia con i cosiddetti "radioligandi", che utilizza farmaci radioattivi legati a molecole chiamate "ligandi" (o carrier), capaci a loro volta di legarsi a specifiche cellule tumorali. Il radioligando rilascia radiazione ionizzante direttamente e selettivamente solo nel tumore e permette sia di generare un’immagine utile alla diagnosi della malattia sia di rilasciare una dose terapeutica. Si tratta pertanto di una terapia efficace anche quando il tumore è diffuso in diverse sedi e non è possibile trattarlo con la radioterapia convenzionale o intervenire chirurgicamente.
Sempre grazie agli sviluppi tecnologici degli acceleratori, crescono i progetti per l’implementazione clinica della boron neutron capture therapy (BNCT), che sfrutta la reazione nucleare tra neutroni di bassa energia con nuclei di boro-10 e la conseguente formazione di nuclei radioattivi nei tumori, dove si concentra il farmaco iniettato al paziente arricchito con boro-10. Il decadimento dei nuclei radioattivi libera radiazioni ionizzanti direttamente dentro le cellule tumorali (vd. fig. b).
Per l’implementazione clinica della BNCT la ricerca contribuisce allo sviluppo di acceleratori compatti, di modelli radiobiologici per la pianificazione del trattamento, oltre a nuovi farmaci e metodi per la somministrazione efficace e sicura del boro. Quest’ultimo è anche protagonista di un’altra ricerca di frontiera: la proton boron capture therapy (PBCT), che sfrutta la reazione nucleare dei protoni con il boro per aumentare l’efficacia dei trattamenti con protoni.
Il futuro della fisica medica è oggi guidato dalla crescente comprensione dei meccanismi biologici dei tumori e delle differenze fra tessuti malati e sani nel reagire al danno indotto dalle radiazioni. Di grande attualità è l’effetto flash – già osservato in studi su animali e oggetto di pianificazione dei primi trial clinici – che provoca una sostanziale riduzione del danno biologico dei tessuti sani a parità di efficacia nel controllo della malattia, quando la dose richiesta è erogata in tempi molto brevi. Un trattamento flash ha una durata inferiore al decimo di secondo, tempo che va confrontato con i trattamenti radioterapici tradizionali, in cui la dose totale è erogata in circa 30 frazioni giornaliere ciascuna della durata di circa un minuto. Se i differenti meccanismi di riparazione del danno indotto da altissimi ratei di dose su cellule e tessuti differenti sono ancora in parte da comprendere, le prospettive cliniche della radioterapia flash sono evidenti e rilevanti poiché permettono tempi di terapia drasticamente ridotti, con una conseguente riduzione delle liste di attesa e dei costi per paziente.
A piccoli passi, progetto dopo progetto, l’INFN contribuisce a portare in clinica terapie innovative e personalizzate grazie a innovativi acceleratori e rivelatori di particelle, sviluppando modelli radiobiologici e strumenti per l’erogazione e la pianificazione dei trattamenti, e puntando su precisione, velocità ed efficacia.
La ricerca sui radiofarmaci
I radiofarmaci sono molecole in grado di trasportare in modo selettivo un atomo radioattivo, detto "radionuclide" (vd. anche Radiazioni che ci circondano, ndr), fino all’organo/tessuto di interesse e possono essere utilizzati a scopo diagnostico e terapeutico, a seconda delle caratteristiche di decadimento del radionuclide. Radionuclidi che emettono radiazione elettromagnetica (raggi γ) possono essere utilizzati per la diagnosi sfruttando le tecniche diagnostiche SPECT e PET che, grazie a una γ-camera, consentono di ottenere un’immagine che permette la localizzazione del tracciante radioattivo.
Si ha invece un effetto terapeutico se vengono usati radionuclidi che emettono particelle cariche (ad esempio particelle α ed elettroni), la cui energia ceduta ai tessuti induce un effetto letale sulle cellule con le quali il radiofarmaco viene a contatto.
Nei Laboratori Nazionali di Legnaro (LNL), grazie al nuovo ciclotrone del progetto SPES (Selective Production of Exotic Species), in grado di accelerare protoni fino a 70 MeV, sarà possibile produrre i radionuclidi con due diverse tecniche complementari: ISOL (Isotope Separation On-Line) e attivazione diretta.
La tecnica ISOL (progetto ISOLPHARM) prevede l’irraggiamento di un bersaglio in carburo che a temperature oltre i 2000 °C rilascia i radionuclidi prodotti dalle reazioni nucleari. Gli atomi ionizzati diventano così un fascio radioattivo che può essere purificato con intensi campi elettromagnetici che consentono di separare i radionuclidi medicali dai contaminanti.
Il progetto LARAMED sfrutta invece il fascio di protoni del ciclotrone SPES e la tecnica dell’attivazione diretta per la produzione di radionuclidi e, di conseguenza, di radiofarmaci innovativi.
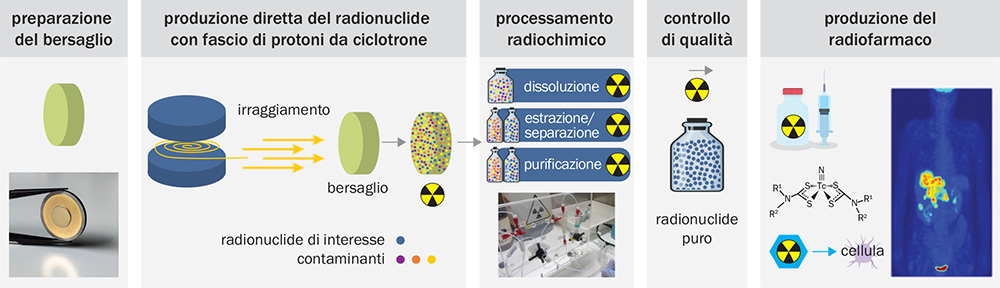
LARAMED (LAboratorio di RAdionuclidi per la MEDicina): schema del ciclo di produzione dei radionuclidi con attivazione diretta del bersaglio.
Biografia
Liliana Mou è tecnologa presso i Laboratori Nazionali di Legnaro (LNL) e afferente al servizio Radioisotopi per la Medicina e la Fisica Applicata della Divisione Ricerca. Come membro della collaborazione LARAMED (LAboratorio di RAdionuclidi per la MEDicina), si dedica principalmente alla misura di sezioni d’urto nucleari per la produzione di radionuclidi di interesse medicale.
Biografia
Simona Giordanengo è ricercatrice presso la sezione INFN di Torino. Si occupa di nuove tecnologie per rivelatori e sistemi di monitoraggio della dose in radioterapia con fasci esterni. Ha contribuito allo sviluppo e realizzazione del sistema clinico di erogazione della dose del CNAO. È attiva in progetti di divulgazione della fisica applicata alla medicina ed è coordinatrice delle attività di ricerca tecnologica della sezione di Torino.



 ©asimmetrie
©asimmetrie